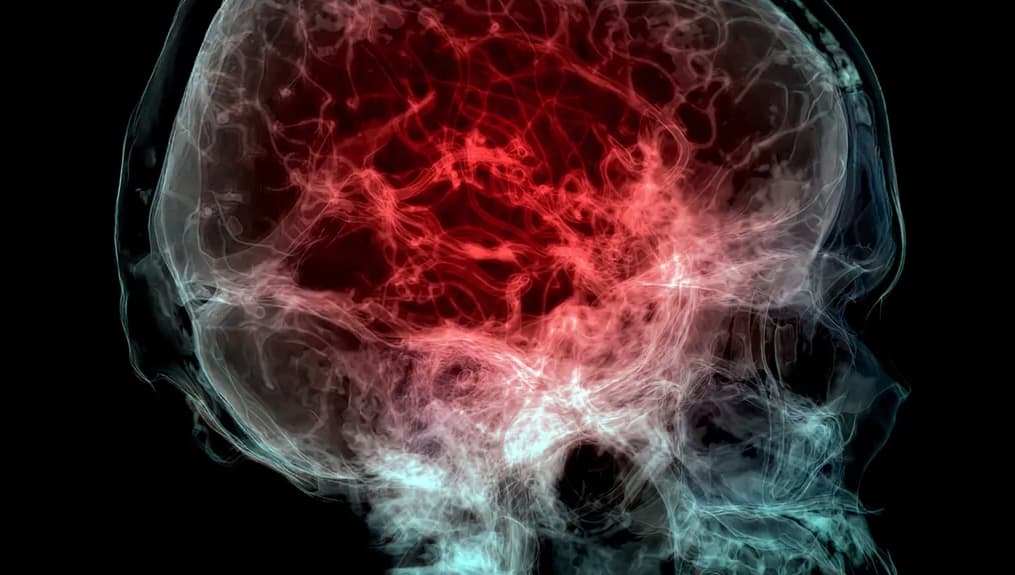
Cette tomodensitométrie colorisée révèle les vaisseaux sanguins dans le cerveau. Selon une nouvelle étude, les microplastiques s’accumuleraient à des niveaux plus élevés dans le cerveau humain que dans le foie et les reins.

Dernière révision médicale : juillet 2023
Le système nerveux est constitué du système nerveux central et du système nerveux périphérique. L’encéphale et la moelle épinière forment le système nerveux central. Le système nerveux périphérique comprend tous les nerfs situés hors de l’encéphale et de la moelle épinière. Trois types de nerfs font partie du système nerveux périphérique.
Les nerfs sensitifs contrôlent la capacité de ressentir les choses, comme la douleur et la température.
Les nerfs moteurs contrôlent les mouvements, comme la marche et le levage de poids et d’haltères.
Les nerfs autonomes contrôlent les choses dont nous ne sommes pas conscients, comme la respiration et les battements du cœur.
Très intéressant ! ![]()
Évoqué par Mag_LLC mais qu’est-ce donc qu’une NOIA NA ?
La neuropathie optique ischémique antérieure non artéritique (NOIAN) désigne une perte de flux sanguin vers le nerf optique (le câble reliant l’œil au cerveau). Cette affection entraîne généralement une perte soudaine de la vision d’un œil, indolore. Dans de nombreux cas, le patient constate une perte significative de la vision d’un œil dès son réveil. La perte visuelle reste généralement stable, sans amélioration ni aggravation notables.
…
(traduction google)
Comme vous Cathy3…
Il va falloir aller fouiller sur internet pour confirmer cette info…du boulot ![]() !
!
Oui , du boulot en perspective Miclo ! ![]()

La Leucémie Lymphoïde Chronique (LLC)
Le traitement de la Leucémie Lymphoïde Chronique (LLC) dépend de plusieurs facteurs, tels que le stade de la maladie, les symptômes du patient, et la présence de facteurs pronostiques défavorables. Voici un aperçu détaillé des stratégies thérapeutiques actuelles pour la LLC :
Résumé
1. Observation et Surveillance Active
-
Indication : Pour les patients asymptomatiques ou ceux présentant une LLC indolente (peu de symptômes, une évolution lente de la maladie).
-
Approche : Dans ces cas, aucun traitement immédiat n’est nécessaire. Une surveillance active consiste en des visites régulières pour suivre l’évolution de la numération sanguine et surveiller les signes d’aggravation de la maladie.
2. Chimiothérapie de Première Ligne (Chimiothérapie-anti-CD20)
-
Indication : Pour les patients symptomatiques ou ceux dont la LLC progresse, par exemple avec une augmentation rapide des ganglions lymphatiques, des infections récurrentes, ou une dégradation de l’état général.
-
Régimes de traitement classiques :
-
Fludarabine + Chlorambucil ou Cyclophosphamide (combinaisons possibles).
-
Rituximab (anticorps anti-CD20) : utilisé en association avec les agents chimiothérapeutiques pour détruire les lymphocytes B (qui sont les cellules cancéreuses dans la LLC). Le rituximab est couramment combiné avec Fludarabine ou Chlorambucil.
3. Inhibiteurs de la Kinase Bruton’s (BTK)
-
Indication : Un traitement plus récent qui a révolutionné le traitement de la LLC.
-
Médicaments :
-
Ibrutinib (le plus utilisé).
-
Acalbrutinib (moins d’effets secondaires cardiovasculaires que l’Ibrutinib).
-
Ces médicaments bloquent la kinase Bruton’s (BTK), une enzyme clé dans la signalisation des cellules tumorales de la LLC, permettant ainsi d’arrêter la croissance des cellules cancéreuses.
-
Avantages : Les inhibiteurs de la BTK peuvent être utilisés même chez les patients âgés ou ceux ayant des comorbidités, car ils sont moins toxiques que la chimiothérapie classique.
4. Inhibiteurs de la Phosphatidylinositol-3-Kinase (PI3K)
-
Médicaments :
-
Idélalisib et Duvelisib.
-
Ces médicaments ciblent la voie de signalisation PI3K, impliquée dans la prolifération des cellules tumorales dans la LLC.
-
Ces traitements sont également plus efficaces chez les patients qui ne répondent pas aux autres traitements (chimiothérapie ou Ibrutinib).
5. Inhibiteurs de l’Apoptose (BCL-2)
-
Médicament :
-
Venetoclax : un inhibiteur de la protéine BCL-2 qui favorise la mort cellulaire programmée des cellules cancéreuses.
-
Indication : Souvent utilisé pour les patients ayant échoué aux traitements précédents, notamment dans les formes réfractaires de la LLC.
-
Mode d’action : En inhibant BCL-2, un régulateur de l’apoptose, Venetoclax entraîne la mort des cellules tumorales tout en préservant les cellules normales.
6. Traitement de l’Infection
-
Les patients atteints de LLC ont un risque accru d’infections en raison de l’immunosuppression liée à la maladie.
-
Prévention et traitement des infections sont donc essentiels dans la prise en charge :
-
Prophylaxie contre les infections à Pneumocystis jirovecii (via triméthoprime-sulfaméthoxazole) pendant certains traitements.
-
Vaccination appropriée, mais les vaccins à base de virus vivants sont souvent contre-indiqués chez ces patients.
7. Greffe de Cellules Souches Hématopoïétiques (GCSH)
-
Indication : Rarement indiquée, la greffe de cellules souches hématopoïétiques peut être envisagée chez certains patients jeunes présentant une forme agressive ou réfractaire de LLC.
-
La GCSH offre une possibilité de guérison, mais elle est réservée aux cas les plus graves en raison des risques et de la complexité du traitement.
Stratégie de Traitement selon le Profil du Patient :
-
Formes indolentes et asymptomatiques : Surveillance active sans traitement immédiat.
-
Formes symptomatiques ou agressives : Chimiothérapie combinée avec un anti-CD20 (rituximab) ou traitement par Ibrutinib, Venetoclax, ou Idélalisib, selon les caractéristiques spécifiques du patient.
-
Relapses ou formes réfractaires : Ibrutinib, Venetoclax, ou combinaison de ces agents.
Pronostic et Suivi :
-
Pronostic : La LLC est une maladie à évolution lente. Le pronostic dépend des caractéristiques cytogénétiques et moléculaires (telles que la présence de mutations de TP53, del(17p), ou mutations de MYD88).
-
Suivi : Les patients sous traitement par inhibiteurs de BTK ou Venetoclax nécessitent un suivi rigoureux pour détecter les effets secondaires (comme les infections, les anomalies cardiaques, ou les syndromes de lyse tumorale).
En résumé, le traitement de la LLC varie en fonction de l’âge du patient, de l’agressivité de la maladie et des comorbidités. Le traitement moderne met l’accent sur des thérapies ciblées (inhibiteurs de la BTK, Venetoclax), avec une chimiothérapie de moins en moins utilisée dans les formes moins agressives.
Voici une présentation détaillée de Venetoclax :
Venetoclax est un médicament relativement récent qui a transformé le traitement de la leucémie lymphoïde chronique (LLC) et d’autres cancers du sang. Il agit en ciblant une protéine spécifique appelée BCL-2, qui joue un rôle clé dans la survie des cellules tumorales.
Résumé
1. Mécanisme d’Action
Venetoclax est un inhibiteur sélectif de la protéine BCL-2. La protéine BCL-2 est impliquée dans la régulation de l’apoptose (mort cellulaire programmée) en inhibant la mort cellulaire. Cela permet aux cellules cancéreuses, comme celles de la LLC, de survivre et de proliférer de manière incontrôlée.
-
BCL-2 : Il est surexprimé dans de nombreuses cellules cancéreuses, ce qui permet aux cellules tumorales d’éviter la mort cellulaire.
-
Venetoclax se lie directement à BCL-2, inhibe son activité et déclenche la mort des cellules tumorales en facilitant leur apoptose.
Ce mécanisme est particulièrement utile dans des pathologies comme la LLC, où les cellules malignes dépendent fortement de BCL-2 pour leur survie.
2. Indications
Venetoclax est principalement utilisé dans les leucémies et certains types de lymphomes. Les principales indications incluent :
-
Leucémie lymphoïde chronique (LLC) :
-
En monothérapie ou en association avec des médicaments comme Rituximab pour les patients ayant échoué aux traitements antérieurs.
-
Utilisé dans des formes réfractaires ou relapsées (qui ne répondent plus aux traitements standards).
-
Lymphome à cellules du manteau (LCM) : utilisé dans les cas réfractaires ou récurrents.
-
Leucémie aiguë myéloïde (LAM) : dans certaines situations, notamment dans les cas de mutations spécifiques.
3. Posologie
-
Début du traitement : La démarche posologique avec Venetoclax nécessite souvent une augmentation progressive de la dose pour réduire le risque de syndrome de lyse tumorale aiguë (SLTA), un effet secondaire grave lié à la libération rapide de contenu cellulaire après la destruction des cellules tumorales.
-
Schema : En général, le traitement débute avec une dose faible, qui est augmentée sur plusieurs semaines :
-
Phase d’initiation : Commence souvent à une dose de 20 mg par jour pendant la première semaine.
-
La dose est ensuite augmentée progressivement, atteignant la dose cible de 400 mg par jour en fonction de la tolérance.
-
Durée du traitement : Le traitement est habituellement à long terme, avec un suivi strict des effets secondaires et des paramètres biologiques.
4. Effets Secondaires
Les effets secondaires de Venetoclax peuvent inclure :
-
Syndrome de lyse tumorale aiguë (SLTA) : Il s’agit d’un effet secondaire grave, surtout en début de traitement, causé par la destruction rapide des cellules tumorales. Le SLTA peut entraîner une hyperkaliémie, hyperphosphatémie, hyperuricémie, et insuffisance rénale aiguë. C’est pourquoi une surveillance étroite (notamment des électrolytes) est nécessaire.
-
Infections : Comme pour d’autres traitements de la LLC, les patients sous Venetoclax ont un risque accru de syndromes infectieux, notamment les infections respiratoires.
-
Neutropénie : Une baisse des globules blancs peut survenir, rendant les patients plus susceptibles aux infections.
-
Diarrhée : Fréquente, mais généralement gérable avec des traitements symptomatiques.
-
Fatigue : Les patients peuvent ressentir de la fatigue en raison de la suppression de la fonction médullaire ou des effets secondaires du traitement.
5. Surveillance et Précautions
-
Suivi de la fonction rénale et des électrolytes : La surveillance des niveaux d’urée, de créatinine, de potassium et de phosphate est essentielle en raison du risque de syndrome de lyse tumorale.
-
Prévention du syndrome de lyse tumorale (SLTA) : Une hydratation adéquate et un ajustement progressif de la dose sont nécessaires pour prévenir ce syndrome.
-
Surveillance des infections : Les patients doivent être suivis régulièrement pour dépister d’éventuelles infections, surtout pendant les périodes de neutropénie.
6. Contre-indications et Précautions d’emploi
-
Allergies ou hypersensibilité au Venetoclax ou à un de ses composants.
-
Syndrome de lyse tumorale : Les patients ayant une charge tumorale élevée nécessitent une attention particulière avant de commencer le traitement.
-
Infections graves non contrôlées : La prise de Venetoclax peut être contre-indiquée en cas d’infections sévères, jusqu’à ce qu’elles soient traitées de manière adéquate.
-
Grossesse et allaitement : Venetoclax n’est pas recommandé pendant la grossesse (catégorie D de l’FDA), et l’allaitement doit être évité pendant le traitement.
7. Avantages de Venetoclax
-
Efficacité : Très efficace, notamment dans les formes réfractaires de la LLC, avec de nombreuses études montrant des rémissions profondes, voire durables.
-
Moins toxique que la chimiothérapie classique : Il n’entraîne pas de suppression complète de la moelle osseuse comme la chimiothérapie, ce qui est un avantage pour les patients âgés ou en mauvais état général.
8. Résumé
Venetoclax est un traitement innovant pour la leucémie lymphoïde chronique (LLC) et d’autres cancers du sang. Il agit en inhibant la protéine BCL-2, essentielle à la survie des cellules cancéreuses. Utilisé principalement dans les cas réfractaires ou en rechute, il a montré une efficacité impressionnante, mais nécessite une surveillance étroite au début du traitement en raison du risque de syndrome de lyse tumorale. Il est souvent administré en combinaison avec Rituximab dans la LLC.
L’après-traitement pour la Leucémie Lymphoïde Chronique (LLC)
L’après-traitement pour la Leucémie Lymphoïde Chronique (LLC) après un traitement par Venetoclax ou tout autre médicament varie en fonction de l’évolution de la maladie, de la réponse au traitement et des effets secondaires qui peuvent persister. Voici les principales étapes à suivre après la fin du traitement, ainsi que ce qu’il faut surveiller à long terme.
Résumé
1. Suivi Clinique et Surveillance
Après un traitement, un suivi clinique est crucial pour détecter toute récidive de la maladie, surveiller les effets secondaires persistants, et garantir que le patient retrouve une bonne qualité de vie. Les principales étapes comprennent :
a. Suivi Oncologique
-
Visites régulières : Le suivi est effectué tous les 1 à 3 mois dans la première année après le traitement, puis à des intervalles plus longs, selon l’état du patient.
-
Évaluation des signes de récidive : Les symptômes de récidive ou de progression de la maladie peuvent inclure des ganglions lymphatiques enflés, une fatigue persistante, des infections récurrentes, ou une baisse de l’hémoglobine.
-
Examen clinique : Vérification de la présence de signes cliniques de récidive (par exemple, en examinant les ganglions lymphatiques et la rate).
b. Analyses Sanguines
-
Numération sanguine complète : Suivi des globules blancs, des plaquettes et de l’hémoglobine pour évaluer la fonction sanguine.
-
Immunoglobulines : Surveillance des niveaux d’anticorps, car les patients atteints de LLC sont souvent immunodéprimés et peuvent avoir un risque accru d’infections.
-
Tests de fonction rénale et hépatique : Ces tests permettent de surveiller les effets à long terme de la chimiothérapie et des traitements ciblés (par exemple, Venetoclax).
-
Bilan cytogénétique : Rechercher la présence d’anomalies chromosomiques comme la del(17p) ou la mutation TP53, qui sont des marqueurs de mauvaise réponse au traitement et peuvent prédire une récidive.
2. Effets Secondaires à Long Terme
Les effets secondaires de Venetoclax et des traitements précédents peuvent persister après la fin du traitement, et doivent être surveillés. Voici les principaux effets secondaires à long terme :
a. Syndrome de Lyse Tumorale (SLTA)
- Bien que le SLTA soit plus fréquent au début du traitement, certains patients peuvent présenter des signes tardifs. Une surveillance continue des électrolytes (potassium, phosphate, calcium) est essentielle.
b. Infections récurrentes
-
Immunosuppression : Après le traitement, les patients peuvent être encore immunodéprimés, ce qui augmente le risque d’infections. Cela inclut les infections respiratoires, urinaires, et fongiques.
-
Prophylaxie antibiotique : Des médicaments pour prévenir certaines infections, comme la pneumocystose, peuvent être administrés à long terme.
c. Troubles hématologiques
-
Neutropénie : La baisse des globules blancs peut persister, augmentant le risque d’infections. Une surveillance régulière des globules blancs est nécessaire.
-
Anémie ou thrombopénie : Certains patients peuvent continuer à avoir une numération plaquettaire ou une hémoglobine plus faible que la normale.
d. Problèmes cardiaques
- Ibrutinib (souvent utilisé avec Venetoclax) est connu pour entraîner des problèmes cardiaques (comme des arythmies). Bien que cela ne soit pas aussi commun avec Venetoclax seul, une surveillance régulière du rythme cardiaque peut être recommandée, notamment si d’autres médicaments sont utilisés en combinaison.
3. Évaluation de la Réponse au Traitement
a. Réponse moléculaire
-
La réponse moléculaire complète est un objectif clé du traitement de la LLC. Cela implique la disparition des cellules cancéreuses au niveau moléculaire, que l’on évalue par des tests comme la PCR quantitative.
-
Si une réponse moléculaire complète est obtenue, cela peut signifier que la maladie est sous contrôle et qu’une récidive est moins probable dans l’immédiat.
b. Survie sans progression (PFS)
-
Le PFS est l’une des principales mesures de l’efficacité du traitement. Après un traitement avec Venetoclax, il est important de surveiller les signes de progression de la maladie.
-
Les tests d’imagerie comme les échographies abdominales et les scanners peuvent être effectués si des ganglions lymphatiques élargis ou d’autres signes de progression sont détectés.
4. Réactions au Traitement et Planification de la Gestion des Effets à Long Terme
a. Problèmes musculaires et articulaires
- Certains patients sous traitement par Venetoclax peuvent développer des douleurs musculaires ou articulaires, nécessitant un suivi spécifique et une gestion symptomatique (analgésiques ou thérapies physiques).
b. Anxiété et dépression
- Le diagnostic de la LLC et le traitement intensif peuvent avoir un impact psychologique. Il est essentiel de soutenir le patient sur le plan psychologique. Des consultations avec des psychologues ou des psychiatres peuvent être utiles.
5. Réduire les Risques de Récidive
Il existe certaines stratégies pour réduire les risques de récidive ou de progression après le traitement :
a. Activité physique
- La pratique régulière d’une activité physique modérée (comme la marche, la natation ou le vélo) peut améliorer la qualité de vie, réduire la fatigue et aider à maintenir un bon état général.
b. Alimentation équilibrée
- Une alimentation saine joue un rôle crucial dans la récupération et la gestion des effets secondaires. Il est conseillé d’avoir une alimentation riche en vitamines, minéraux et protéines pour soutenir le système immunitaire et prévenir les complications.
c. Suivi des vaccins
- La vaccination est importante, mais il faut éviter les vaccins à base de virus vivants pendant le traitement. Après la fin du traitement, un rattrapage vaccinal peut être nécessaire.
6. Retour à la vie normale
Après la fin du traitement, beaucoup de patients peuvent progressivement revenir à une vie normale, mais le rythme dépend de chaque cas individuel. Un patient peut nécessiter des ajustements dans son mode de vie pour gérer certains effets secondaires ou pour prévenir une récidive.
En résumé :
L’après-traitement de la LLC, notamment après l’utilisation de Venetoclax, consiste principalement en une surveillance clinique et biologique étroite. Les patients doivent être suivis régulièrement pour surveiller la réponse au traitement, prévenir les complications et gérer les effets secondaires à long terme. La gestion de la qualité de vie et la prévention des récidives sont aussi des objectifs importants.
Si tu souhaites plus de détails sur l’une de ces étapes ou des informations supplémentaires sur l’après-traitement spécifique, n’hésite pas à me demander !
La rechute dans la leucémie lymphoïde chronique (LLC) se produit lorsque la maladie revient après un traitement initial qui avait bien contrôlé la maladie. La rechute peut survenir après une période de rémission complète ou après une réponse partielle au traitement. Le processus de gestion de la rechute nécessite une évaluation approfondie et un choix de traitement adapté en fonction des caractéristiques de la rechute, de l’état général du patient, et des traitements antérieurs.
LLC la Rechute
Voici un guide détaillé sur la prise en charge des rechutes de LLC :
Résumé
1. Évaluation de la Rechute
Avant de prendre toute décision sur le traitement après une rechute, il est essentiel d’évaluer plusieurs facteurs :
a. Caractéristiques de la rechute
-
Temps de rechute : Une rechute précoce (dans les 12 à 24 mois après la fin du traitement) peut être un signe de mauvais pronostic, tandis qu’une rechute plus tardive pourrait être plus facilement traitée.
-
Charge tumorale : La taille des ganglions lymphatiques et la présence de symptômes (comme la fièvre, la perte de poids, la fatigue) sont des indicateurs importants.
b. Tests génétiques et cytogénétiques
-
Mutations TP53 et del(17p) : Ces anomalies chromosomiques sont des facteurs pronostiques négatifs. Si ces mutations sont présentes, cela indique une résistance aux traitements classiques comme la chimiothérapie ou certains traitements ciblés.
-
Anomalies génétiques supplémentaires : Des tests peuvent rechercher des anomalies spécifiques dans le profil génétique des cellules tumorales pour guider le choix du traitement (ex. mutation MYD88).
c. Test de sensibilité aux traitements précédents
- Réponse aux traitements antérieurs : Savoir si la rechute survient après une réponse incomplète ou partielle aux traitements précédents peut orienter le choix de la thérapie suivante.
2. Options de Traitement en Cas de Rechute
Le traitement de la rechute dépend de plusieurs facteurs, notamment des médicaments déjà utilisés, de l’âge du patient, et des caractéristiques de la maladie. Voici les principales stratégies thérapeutiques :
a. Inhibiteurs de la Kinase Bruton’s (BTK)
Les inhibiteurs de la BTK (comme Ibrutinib, Acalbrutinib, et Zanubrutinib) sont devenus des traitements de référence dans la LLC, y compris pour les rechutes.
-
Ibrutinib : Si le patient n’a pas déjà été traité avec cet inhibiteur, il peut être une option. Il est efficace même en cas de mutations TP53 et de del(17p), qui confèrent une résistance à la chimiothérapie.
-
Acalbrutinib : Un inhibiteur de la BTK plus sélectif, avec un profil d’effets secondaires plus favorable par rapport à l’Ibrutinib, notamment pour les effets cardiovasculaires.
-
Zanubrutinib : Un autre inhibiteur de la BTK, similaire à l’Ibrutinib, mais avec une meilleure sélectivité et moins d’effets secondaires.
b. Inhibiteurs de BCL-2 (comme Venetoclax)
-
Venetoclax est souvent utilisé en cas de rechute, notamment en combinaison avec d’autres médicaments comme Rituximab. Cela peut être particulièrement efficace pour les patients ayant des mutations TP53 ou ceux qui ont échoué aux traitements par inhibiteurs de la BTK.
-
La combinaison Venetoclax + Rituximab a montré de bons résultats dans les rechutes de LLC, avec des taux de réponse très élevés.
c. Chimiothérapie combinée
-
Dans les cas où les traitements par inhibiteurs de la BTK et Venetoclax échouent ou ne sont pas disponibles, une chimiothérapie combinée avec un anticorps anti-CD20 (comme Rituximab) peut être utilisée.
-
Fludarabine + Cyclophosphamide (FC) ou Chlorambucil + Rituximab sont des options classiques de chimiothérapie. Cependant, cette approche est souvent moins favorable pour les patients présentant des mutations TP53, car ces mutations rendent la chimiothérapie moins efficace.
d. Allogreffe de cellules souches hématopoïétiques (GCSH)
-
La greffe de cellules souches hématopoïétiques (GCSH) peut être envisagée dans les cas de rechute réfractaire ou agressive chez les patients jeunes et en bon état général. Cette option est généralement réservée aux cas où les traitements médicamenteux échouent et qu’une guérison potentielle est envisagée.
-
Une greffe allogénique (provenant d’un donneur) est plus couramment utilisée que l’autogreffe, car elle permet de restaurer une fonction immunitaire efficace contre la rechute.
e. Autres thérapies ciblées
-
Idélalisib ou Duvelisib (inhibiteurs de la voie PI3K) peuvent être utilisés dans des cas réfractaires où les autres thérapies ont échoué.
-
Ces médicaments sont souvent utilisés lorsque les inhibiteurs de la BTK et Venetoclax ne sont pas efficaces ou ne conviennent pas au patient.
3. Surveillance et Suivi après une Rechute
Une fois le traitement de la rechute commencé, une surveillance étroite est nécessaire pour suivre la réponse thérapeutique et ajuster le traitement si nécessaire :
-
Suivi des paramètres biologiques : Cela comprend la numération sanguine, les électrolytes (surtout si un traitement comme Venetoclax est utilisé), et les tests de fonction rénale.
-
Imagerie médicale : Un suivi par échographie, scintigraphie, ou tomodensitométrie (TDM) peut être utilisé pour évaluer la taille des ganglions lymphatiques et d’autres sites d’atteinte tumorale.
-
Évaluation de la réponse au traitement : Une réponse partielle ou complète est régulièrement évaluée pour savoir si le traitement est efficace. Cela peut impliquer des tests moleculaires pour détecter la disparition des cellules tumorales à un niveau génétique.
-
Prévention des infections : La surveillance des infections reste essentielle, notamment pour les patients ayant subi une greffe ou ceux sous traitement immunosuppresseur.
4. Gestion des Effets Secondaires à Long Terme
Les effets secondaires des traitements de rechute, comme l’Ibrutinib ou le Venetoclax, doivent également être gérés à long terme :
-
Surveillance cardiovasculaire : Les inhibiteurs de la BTK peuvent entraîner des arythmies cardiaques ou des hypertension, donc des examens cardiaques réguliers sont nécessaires.
-
Surveillance de la fonction hépatique et rénale : Certains traitements peuvent affecter les organes vitaux, donc un suivi régulier des fonctions rénale et hépatique est primordial.
-
Risque accru d’infections : Avec la chimiothérapie ou les traitements ciblés, le patient peut être vulnérable aux infections, nécessitant une prophylaxie et une surveillance continue.
5. Pronostic après une Rechute
Le pronostic après une rechute dépend de plusieurs facteurs :
-
Temps de rechute : Une rechute précoce après un premier traitement peut indiquer un pronostic plus défavorable.
-
Réponse au traitement de rechute : Si le patient répond bien au traitement de rechute (notamment avec des inhibiteurs de la BTK ou Venetoclax), cela peut permettre de prolonger la survie sans progression.
-
Mutations génétiques : La présence de mutations TP53 ou de del(17p) dans les cellules tumorales est un indicateur de résistance aux traitements classiques, ce qui peut réduire les chances de rémission durable après la rechute.
Conclusion
La rechute de la LLC peut être difficile à gérer, mais les traitements modernes offrent des options efficaces, comme les inhibiteurs de la BTK (Ibrutinib, Acalbrutinib) et Venetoclax, qui ont montré une bonne efficacité même dans les formes réfractaires. En cas de rechute, un suivi régulier et une gestion des effets secondaires sont essentiels pour optimiser la réponse au traitement et maintenir la qualité de vie du patient.
Bonjour.
Pourquoi parler d’“après traitement” s’agissant d’une LLC, alors que notre traitement est à prendre à vie, pour certain(e)s , notamment nous qui sommes sous Calquence ? Qu’est ce qui m’échappe ? ![]()
Bonjour Cathy,
Parce que l’article parle des traitements à durée fixe comme le Venetoclax (associé à l’obituzinab ou l’ibrutinib), nous sommes plusieurs dans ce cas, dont je fais partie comme ÀJacquel et d’autres. Nous sommes donc sous surveillance comme la période avant traitement… ![]()
![]()
![]()
Bon dimanche à tous
Bonjour Mag.
Quelles sont donc les critères pour prendre ce traitement curatif qui vous permet de vous passer de tout traitement actuellement, plutôt que le Calquence qui est à vie ( enfin, il sera sûrement remplacé par un autre au bout de quelques années, mais il faut impérativement un traitement ou un autre).
Est ce une histoire de mutation ? ![]()
Re bonjour Cathy,
Je ne sais pas trop, je sais que le Venetoclax en mono thérapie est ancien et ne donnait pas de très bons résultats. Son association avec l’obinutuzimab ou l’ibrutinib est plus récente et donne de bons résultats.
Je me réfère à cette étude :
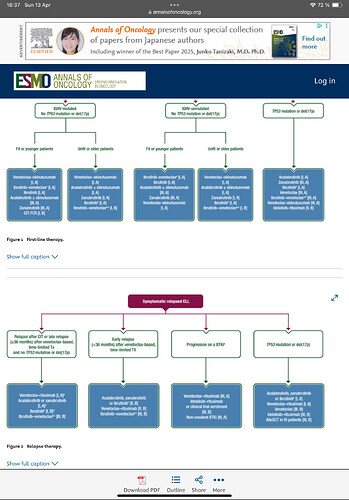
https://www.annalsofoncology.org/article/S0923-7534(24)00747-6/fulltext
En 2e intention (graphique du dessous), on peut avoir rituximab-Venetoclax ou ibrutinib-Venetoclax. Moi j’ai déjà tout eu, donc je ne sais pas si ils auront une botte secrète ou si je pourrai reprendre la même chose ![]()
![]()
Ah oui ! Merci Mag. Effectivement c’est une question de mutation d’après ces graphiques…
Vous avez déjà tout eu ? ![]()
Bon, d’ici à ce que vous rechutiez, un nouveau médicament sera sorti, à n’en pas douter ! Plus performant encore ! ![]()
![]()
Oui si vous avez TP53, vous êtes dans la colonne de droite (avec notamment le Calquence en monotherapie)
Oui avec mon hémolyse ils m’avaient donné du rituximab. On croise les doigts que la recherche avance ![]()
Je n’ai heureusement pas la mutation TP53 mais en cas de rechute c’est le risque pour nous tous. On croise les doigts ![]()
![]()
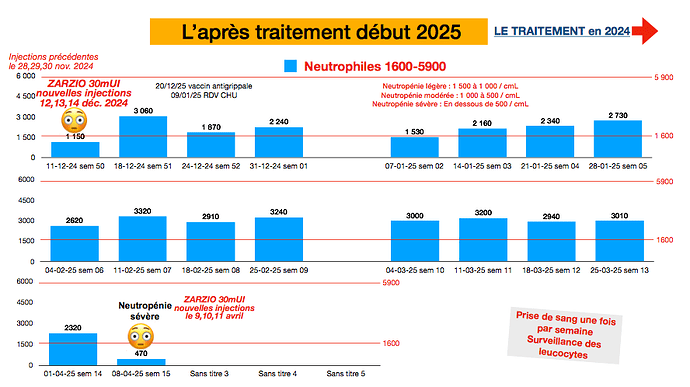
(Arrêt du vénétoclax depuis le 6 nov. 2024.) Depuis quelques jours, arrêt des médicaments (bactrim, valaciclovir, lederfoline). Ouf ! c’est donc la véritable fin du traitement. Mais c’est jamais simple : je viens d’avoir une petite cure de ZARZIO 30mUI après un répit de 4 mois une neutropénie sévère PNN à 470 !
Suivi de ma LLC
Bonjour @AJacquel
Mince alors, comment ça se fait ? Vos lymphocytes restent bas ?
Moi je n’ai plus de pds que tous les 3 mois (je vois que pour vous c’est encore 1 par semaine), j’avoue que ça me stresse un peu de “naviguer à vue”… mais bon j’ai confiance en mon hemato, il ne devrait rien m’arriver ![]()
En fait c’est sur ce post que je m’interrogeais, Cathy3…
J’ai regardé le début de la conférence de M. Holland.
Les effets de résonnances à certaines fréquences sont connues depuis longtemps : un régiment qui marche au pas, rompt le pas en passant sur un pont pour éviter ce genre de choses.
Je m’interroge sur la “méthode scientifique” adoptée pour ces expériences.
Et si cette méthode a été respectée, pourquoi ces résultats, datant de plus de 14 ans si je comprends bien l’explication de TDX (filmé en 2011), ne sont pas mieux diffusés et connus?
Donc, pour y croire, et avec mon vieil esprit cartésien, j’attends des communications officielles disant ok, ces expériences ont été faites dans les règles de l’art.
Et j’aime la musique… ![]()